腸管バリア機能障害に特に注目した迷走神経刺激の抗炎症作用
腸管バリアの役割は、胃腸管に存在する腸内微生物、食物抗原、毒素から宿主を保護することです。
「リーキーガット」と定義されるこのバリア機能不全、破壊は、微生物成分が体内への移動促進し、全身性軽度炎症を誘発する可能性があります。
腸セラピーがこのバリアの回復および修復維持できる革新的な介入かが注目されています。
タイトジャンクション(TJ)は、腸上皮細胞を相互接着し腸バリアを構築しています。
オクルージンとクローディンファミリーのメンバーは、TJを構築する主要なシーリングタンパク質です。これらのタンパク質は、ゾヌラオクルージンタンパク質を含む細胞質タンパク質と相互作用し、TJタンパク質と細胞内のアクチンおよびミオシン収縮要素との間のアダプターとして機能します。
腸管バリア機能の摂動は、IBS、IBD、セリアック病などの胃腸障害で報告されています。
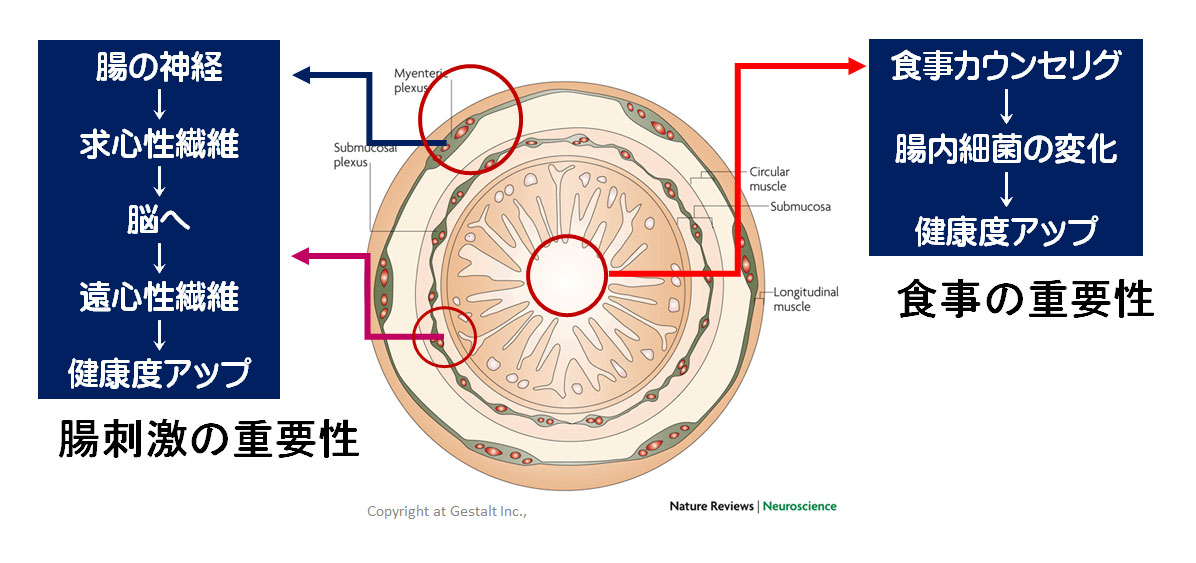
迷走神経とコリン作動性抗炎症経路
脳が腸のバリア機能を調節するメカニズムは、まだ議論の余地があります。
迷走神経は消化管を神経支配する人体の最も長い神経です。腸脳軸の重要な構成要素です。
①視床下部-下垂体副腎(HPA)軸を活性化する求心性神経と②CAPを介した遠心性神経の両方を介して抗炎症特性を持ちます。
CAP炎症抑制経路は、2000年にTraceyのグループによって初めて報告され、アセチルコリン(ACh)の放出によってマクロファージのα7ニコチン性アセチルコリン受容体(α7nAChR)に結合し、TNFαの放出を阻害します。
腸内の迷走刺激はマクロファージと直接相互作用するのではなく、抗炎症シグナルに関連するnNOS-VIP-ACh腸内ニューロン6と相互作用します。
α7nAChRを発現する腸内在筋常在マクロファージは、胃腸CAPの最終的な標的です。
VNは脾臓交感神経とも接続されており、AChを放出する脾臓Tリンパ球のβ2受容体に結合するノルエピネフリンを放出し、α7nAChR、つまり非ニューロンのコリン作動性経路を介して脾臓マクロファージによるTNFα放出を阻害します。
代替経路には、免疫応答で活性化された節後交感神経を介して脾臓交感神経終末を通じ、炎症を抑制する大内臓神経が関与します。
Zhang Xらは、脾臓神経の活動が、α9nAchRによって媒介されるAChに対するB細胞の応答性を必要とする方法で形質細胞の産生を増強することを示しており、コリンアセチルトランスフェラーゼを発現するT細胞は、おそらくノルアドレナリン作動性神経とACh応答性B細胞との間の中継として機能とする。その結果、CRHを発現する扁桃体の中心核と視床下部の傍脳室核のニューロンが脾臓神経とつながっていることが示した。
ストレスは、VNを阻害しながら交感神経系を刺激することが知られており、ストレスは炎症誘発性を持ち、腸の透過性を高める可能性があります。心理的ストレスに起因する CRH が腸粘膜の確立されたエンドトキシン耐性を壊し、臨床的または無症候性の炎症の発症と IBS と IBD の関連状態につながる可能性があると報告しています。
腸管バリア機能障害に特に注目した迷走神経刺激の抗炎症効果 – PMC